Hasta hace años atrás, la formación del Estudiante Químico farmacéutico, estaba abocado, mas a su preparación como tal, y así como el Farmacéutico, especialista en la elaboración y manejo de medicamentos, hoy en día esa preparación es importante para el fundamento de su ejecución laboral.
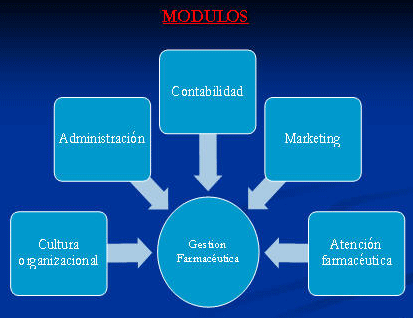
Pero la modernización, la globalización y el amplio campo laboral del mismo, hace necesario que este profesional de la salud, sea cada vez más competitivo, ya que su entorno así lo exige, esa preparación relacionada con la GESTIÓN ADMINISTRATIVA, en estos tiempos son más que esenciales, el conocimiento de la Cultura Organizacional, Administración, Marketing Farmacéutico, Contabilidad, Análisis Financiero, Atención Farmacéutica y otros aspectos afín a la Gestión, van a ser que este profesional sea lo más competitivo posible y esté preparado no solo para el manejo administrativo de un Local Farmacéutico, sino también para las distintas Empresas, de mas exigencia profesional, como las Droguerías, Distribuidoras, Cadenas Farmacéuticas y Laboratorios Farmacéuticos.
Porque, Cultura Organizacional?
Uno de los objetivos del conocimiento de la cultura organizacional es detectar los problemas dentro de las organizaciones y luego poder ofrecer soluciones a estos problemas, así como integrar al personal bajo los objetivos que persigue a la organización.
Por lo tanto, el conocimiento de ello para el profesional, es fundamental para la formación de un buen equipo de trabajo y la instalación de una cultura organizacional optima.
Porque Administración?
La administración como conocimiento para este profesional no solamente es necesario, es de gran utilidad, ya que por las distintas gestiones realizadas en la labor del Químico Farmacéutico en forma diaria, los procesos de Planificación, Organización, Dirección y Control, van a ser que su Gestión Administrativa dentro de ese rubro, sea lo más efectivo posible y pueda conseguir los objetivos planeados, de una forma bien organizada.
Porque Contabilidad?
El análisis financiero en un momento determinado, dentro del proceso del control, para determinar en qué situación se encuentra nuestra organización, nos va permitir realizar las correcciones necesarias para el cumplimiento de los objetivos que se desean conseguir con el tiempo adecuado, de ahí la necesidad de interpretar la parte contable de la empresa.
Porque Marketing?
El Marketing, se ha vuelto últimamente, una de las mejores herramientas dentro de la Planificación, para poder conseguir los objetivos planeados y en el mundo farmacéutico, rubro que cada día está en crecimiento, no solo por países en pleno desarrollo, si no por las mismas empresas farmacéuticas, el profesional que cuenta con estos conocimiento no solo son de utilidad en su sector laboral, si no en la consecución de sus metas planificadas exitosamente, el estudio del marketing en cualquier sector profesional es vital, para los integrantes de una empresa en este caso de la industria farmacéutica.
En cuanto a Atención Farmacéutica, rama del sector, también es importante porque se suma a su preparación, y las herramienta anteriores que son de utilidad para la organización, y el cumplimientos de las metas propuestas para esta clase de Atención al Cliente, uno de los factores fundamentales de la existencia del sector farmacéutico.
Cuál es el significado entonces de Gestión Farmacéutica?
El significado o concepto de la Gestión Farmacéutica, para algunos, seria la forma de hacer las cosas en una farmacia, pero en realidad el concepto seria más amplio, ya que el Químico Farmacéutico, hoy en día, no solo es Director Técnico de un local Farmacéutico, es mucho más que eso, y según el lugar donde ejerza su profesión, el uso de la Cultura Organizacional, Administración, Contabilidad, Marketing, Atención Farmacéutica y por último la esencia de su labor profesional como Gestión Farmacéutica, nos llevaría a un concepto que solo podríamos concebir con la experiencia y el uso de estas herramientas fundamentales, en la Industria Farmacéutica.